Kohlenwasserstoffe
Definition: Stoffe, die nur aus den chemischen Elementen Kohlenstoff und Wasserstoff bestehen
Allgemeinere Begriffe: Brennstoff, Kraftstoff
Spezifischere Begriffe: Alkane, Alkene, Alkine, Zykloalkane, Aromaten
Chemische Formel: CxHy
Englisch: carbon hydrates
Autor: Dr. Rüdiger Paschotta
Wie man zitiert; zusätzliche Literatur vorschlagen
Ursprüngliche Erstellung: 11.01.2015; letzte Änderung: 20.08.2023
URL: https://www.energie-lexikon.info/kohlenwasserstoffe.html
Kohlenwasserstoffe sind Stoffe, die nur aus den chemischen Elementen Kohlenstoff und Wasserstoff bestehen. Der einfachste Kohlenwasserstoff ist das Gas Methan (CH4); ein Molekül davon besteht also aus einem einzigen Kohlenstoffatom (C), mit dem vier Wasserstoffatome (H) verbunden sind. Schwerere Kohlenwasserstoffe können bei Zimmertemperatur flüssig oder auch fest sein.
Manche Autoren verwenden einen erweiterten Begriff von Kohlenwasserstoffen, die auch andere Elemente als Kohlenstoff und Wasserstoff enthalten können. Beispielsweise ist dann von "sauerstoffhaltigen Kohlenwasserstoffen" die Rede; dies können beispielsweise Alkohole, Ether, Ketone und Aldehyde sein.
Kohlenwasserstoffe dienen in riesigen Mengen als Energieträger und werden hauptsächlich aus Erdöl in Erdölraffinerien gewonnen. Es gibt allerdings auch viele andere Anwendungsbereiche wie z. B. die Herstellung von Kunststoffen und vielen Chemikalien sowie die Verwendung als Schmierstoffe, Lösemittel, Treibmittel und Kältemittel.
Alkane
Die strukturell einfachsten Kohlenwasserstoffe sind die linearen Alkane (n-Alkane), bei denen eine Anzahl von Kohlenstoffatomen eine lineare Kette bilden und wiederum Wasserstoffatome mit den Kohlenstoffatomen verbunden sind. Hierbei treten nur so genannte Einfachbindungen auf; es sind also gesättigte Kohlenwasserstoffe. Die beiden äußersten Kohlenstoffatome sind mit jeweils drei Wasserstoffatomen verbunden, die anderen nur mit zweien (siehe Abbildung 1). Das Methan gilt übrigens auch als Alkan, obwohl es keine Kohlenstoffkette enthält.
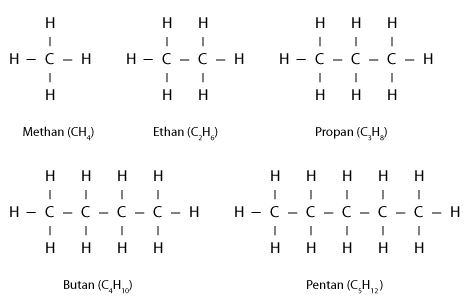
Andere Varianten von Alkanen enthalten verzweigte Moleküle (siehe Abbildung 2); sie werden als Isoalkane oder i-Alkane bezeichnet. Man unterscheidet beispielsweise das lineare n-Butan vom verzweigten Isobutan; beide haben die gleiche Summenformel (C4H10) und werden deswegen als Isomere bezeichnet.
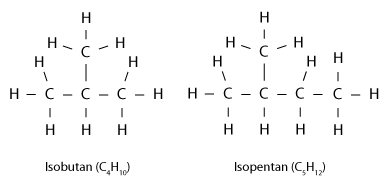
Ansonsten gibt es auch Alkane mit cyclischen (ringförmigen) Molekülen; das einfachste hiervon ist das Cyclohexan (C6H12).
Die leichtesten Alkane (Methan, Ethan, Propan, Butan) sind bei Zimmertemperatur gasförmig. Schwerere Vertreter wie Pentan, Hexan, Heptan und Oktan (wichtige Komponenten von Benzin, Dieselkraftstoffen und Kerosin) sind bei Zimmertemperatur flüssig, und noch schwerere können auch fest sein. Beispielsweise besteht Paraffin hauptsächlich aus längerkettigen Alkanen mit ca. 20 bis 30 Kohlenstoffatomen pro Molekül.
Alkene und Alkine
Die Stoffgruppe der Alkene (alte Bezeichnung: Olefine) bezeichnet Verbindungen, bei denen so genannte Doppelbindungen zwischen Kohlenwasserstoffen vorkommen. In diesem Fall werden weniger Wasserstoffatome angelagert, da hierfür weniger Bindungen zur Verfügung stehen. Man bezeichnet solche Substanzen als ungesättigt. Die einfachsten Alkene sind Ethen (Ethylen) (C2H4), Propen (Propylen) (C3H6), 1-Buten (C4H8) und Isobuten (C4H8). Auch hier gibt es wieder Versionen mit verzweigten Molekülen, was zur Bezeichnung Isoalkene führt. Außerdem unterscheidet man einfach ungesättigte Alkene von mehrfach ungesättigten, die mehrere Doppelbindungen enthalten. Es gibt auch hier wieder cyclische Varianten wie das Cyclohexen (C6H10).
Bei Alkinen kommt mindestens eine Dreifachbindung vor. Einfache Vertreter dieser Gruppe sind das Ethin (Acetylen) (C2H2) und das Propin (C3H4).
Aromatische Kohlenwasserstoffe (Aromaten)
Eine weitere wichtige Substanzgruppe bilden die aromatischen Kohlenwasserstoffe. Diese enthalten cyclische planare Moleküle. Ihr einfachster Vertreter ist das Benzol (Benzen, C6H6), welches einen einzigen Kohlenstoffring enthält. Strukturformeln werden oft mit drei Doppelbindungen und drei Einfachbindungen gezeichnet, obwohl in Wirklichkeit die Bindungselektronen delokalisiert, also gleichmäßig über den Ring verteilt sind. Varianten dieser Moleküle können beispielsweise am Ring angelagerte weitere Gruppen wie z. B. Alkylgruppen enthalten (z. B. bei Toluol).
Kohlenwasserstoffe mit mehreren solcher Ringe werden als polycyclische aromatische Kohlenwasserstoffe (PAK) bezeichnet. (Die Schreibweise polyzyklisch kommt ebenfalls vor.) Die Kohlenstoffringe können entweder direkt miteinander verschmolzen sein (z. B. bei Naphtalin) oder auch nur z. B. über Einfachbindungen miteinander verbunden werden. Viele der polycyclischen Aromaten sind sehr giftig und auch krebserregend (auch bei Hautkontakt) und gelten daher als sehr problematische Umweltschadstoffe. Sie sind natürliche Bestandteile von Erdöl, aber auch von Teer und Kohle. Auch Erdölprodukte wie z. B. Benzin und Dieselkraftstoff enthalten Spuren polycyclischer Aromaten, und solche können auch bei unvollständiger Verbrennung von Kraftstoffen oder anderen Brennstoffen entstehen. Ebenfalls finden sich PAK in Tabakrauch und in heiß gebratenem oder gegrilltem Fleisch. Die Belastung der Luft mit polycyclischen Aromaten geschieht aber hauptsächlich durch die Verbrennung fossiler Energieträger.
Nicht aromatische Kohlenwasserstoffe werden als aliphatische Kohlenwasserstoffe bezeichnet. Beispielsweise gilt Cyclohexan als aliphatisch, Benzen dagegen als aromatisch.
Kohlenwasserstoff-Polymere
Aus Kohlenwasserstoffen können durch sogenannte Polymerisationsreaktionen Moleküle mit sehr langen Kohlenstoffketten entstehen, die als Polymere bezeichnet werden. Diese werden vielfach als Kunststoffe verwendet. Beispiele hierfür sind Polyethylen (Polyethen) und Polypropylen. Kunststoffe enthalten allerdings häufig Additive (z. B. Weichmacher, Stabilisatoren, Verstärkerstoffe und Farbstoffe), die oft selbst nicht Kohlenwasserstoffe sind. Auch sind längst nicht alle Polymere Kohlenwasserstoffe.
Halogenierte Kohlenwasserstoffe
Durch chemische Reaktionen zwischen Kohlenwasserstoffen und Halogen (oder halogenhaltigen Substanzen) können sogenannte halogenierte Kohlenwasserstoffe (Halogenkohlenwasserstoffe) entstehen, von denen die chlorierten und fluorierten Varianten am bedeutsamsten sind. Diese Substanzen sind an sich keine Kohlenwasserstoffe mehr, da sie auch andere Atome als Kohlenstoff- und Wasserstoffatome enthalten.
Halogenkohlenwasserstoffe sind zum Teil sehr giftig und werden beispielsweise als Insektizide und Desinfektionsmittel verwendet. Manche davon sind auch biologisch sehr schwer abbaubar, beispielsweise die extrem giften Dioxine. Andere Halogenkohlenwasserstoffe (z. B. Fluorchlorkohlenwasserstoffe = FCKW) sind zwar ungiftig, schädigen aber die Ozonschicht der Erdatmosphäre, weswegen ihre Verwendung im Rahmen des Montreal-Protokolls seit 1989 weitgehend verboten wurde.
Kohlenwasserstoffe als Energieträger
Fossile Energieträger bestehen zu einem erheblichen Anteil aus Kohlenwasserstoffen. Dies gilt insbesondere für Erdöl und Erdgas. Erdöl ist hauptsächlich ein Gemisch vieler verschiedener Kohlenwasserstoffe, die in Erdölraffinerien teils nur in unterschiedlich schwere Fraktionen aufgetrennt, teils aber auch chemisch umgewandelt werden. Auch aus Biomasse lassen sich mit verschiedenen Verfahren Stoffgemische herstellen, die zu einem wesentlichen Teil aus Kohlenwasserstoffen bestehen. In beiden Fällen können so gewonnene Energieträger auch diverse giftige Substanzen enthalten, beispielsweise Aromaten.
Im Vergleich zu Alkoholen wie Ethanol, deren Moleküle auch Sauerstoffatome enthalten, liegt der Heizwert (also die Energiedichte) reiner Kohlenwasserstoffe höher.
Verbrennung von Kohlenwasserstoffen
Die vollständige Verbrennung von Kohlenwasserstoffen (die ein genügend hohes Verbrennungsluftverhältnis) voraussetzt, führt zu Kohlendioxid (CO2) und Wasserdampf. Es entstehen dabei also im Prinzip keinerlei giftigen Schadstoffe; lediglich ist das entstehende Kohlendioxid klimaschädlich, wenn es nach der Verbrennung wie üblich in die Atmosphäre gelangt und nicht im Rahmen von CCS entsorgt wird.
Wenn die Verbrennung allerdings unvollständig abläuft, kann auch das giftige Kohlenmonoxid (CO) entstehen, und ebenfalls kann es zur Bildung von Ruß in Form von Feinstaub kommen. Ebenfalls können nur teilweise oder gar nicht umgesetzte Kohlenwasserstoffe (unverbrannte Kohlenwasserstoffe) im Abgas verbleiben; die resultierenden Kohlenwasserstoffemissionen (HC-Emissionen) sind sehr unerwünscht und müssen ggf. mithilfe eines Abgaskatalysators reduziert werden. Unverbrannte Kohlenwasserstoffe in der Luft sind nicht nur teils giftig, sondern tragen auch zur Ozonbildung bei.
Vorteile flüssiger und gasförmiger Energieträger
Der flüssige Aggregatszustand vieler Kohlenwasserstoffe ist für die Verwendung als Energieträger häufig günstig: Flüssigkeiten lassen sich leicht lagern und durch Rohrleitungen transportieren. Ebenfalls weisen sie eine viel höhere Dichte (und damit eine entsprechend höhere volumetrische Energiedichte) als Gase auf, ohne dass ein hoher Druck angewandt werden muss. Für die Verbrennung müssen flüssige Kohlenwasserstoffe zunächst verdampft werden, was aber zumindest bei den leichteren Kohlenwasserstoffen kein Problem ist.
Nachteilig ist der Umstand, dass viele Kohlenwasserstoffe wassergefährdend sind und deswegen unbedingt daran gehindert werden müssen, in den Boden und das Grundwasser einzudringen. Zwar mischen sich Kohlenwasserstoffe relativ schwer mit Wasser; sie sind tendenziell hydrophob (wasserabstoßend). Gewisse Mengen giftiger Substanzen können aber trotzdem vom Wasser aufgenommen werden.
Schwere Kohlenwasserstoffe sind tendenziell weniger gut als Energieträger geeignet, da ihre saubere Verbrennung aufwendiger ist. Schweröl wird trotzdem viel verwendet (v. a. für Schiffsantriebe), aber hauptsächlich nur wegen seines niedrigen Preises; ein gewisser Teil des Erdöls wird bei der Verarbeitung in einer Erdölraffinerie kaum vermeidbar zu Schweröl.
Gasförmige Kohlenwasserstoffe wie Methan, Propan und Butan sind besonders leicht sauber (d. h. mit nur minimal giftigen Abgasen) zu verbrennen. Sie können gut durch Rohrleitungen (Pipelines) transportiert werden, allerdings weniger gut in Fahrzeugen mitgeführt werden. Unverbrannt in die Atmosphäre gelangtes Methan ist stark klimaschädlich, während Propan und Butan in relativ kurzer Zeit in der Atmosphäre zu Kohlendioxid und Wasser umgesetzt werden.
Künstlich erzeugte Kohlenwasserstoffe
Mithilfe elektrischer Energie kann durch Elektrolyse Wasserstoff gewonnen werden, der auch als Energieträger dienen kann (→ EE-Gas). Da Kohlenwasserstoffe als Energieträger jedoch vorwiegend günstigere Eigenschaften aufweisen, ist es eine interessante Option, solche aus Wasserstoff und Kohlendioxid herzustellen (→ Power to Gas, Power to X).
Auch sogenannte Synthesekraftstoffe, die beispielsweise durch Biomassevergasung oder auch aus Erdgas gewonnen werden, bestehen hauptsächlich aus Kohlenwasserstoffen. Durch gezielte Steuerung der Prozesse kann die Zusammensetzung dieser Gemische optimiert werden; ihre Qualität als Energieträger ist oft besonders hoch.
Siehe auch: Methan, Propan, Butan, Benzol, Erdöl, Erdgas, Benzin, Dieselkraftstoff, Flüssiggas, Schweröl, Synthesekraftstoff, EE-Gas, Power to Gas, Messverfahren für Kraftstoffverbrauch und Abgaswerte, Verdunstungsemissionen

Wenn Ihnen diese Website gefällt, teilen Sie das doch auch Ihren Freunden und Kollegen mit – z. B. über Social Media durch einen Klick hier:
Diese Sharing-Buttons sind datenschutzfreundlich eingerichtet!